Titin
 Medizinische Expertise: Dr. med. Nonnenmacher
Medizinische Expertise: Dr. med. NonnenmacherQualitätssicherung: Dipl.-Biol. Elke Löbel, Dr. rer. nat. Frank Meyer
Letzte Aktualisierung am: 15. März 2024Dieser Artikel wurde unter Maßgabe medizinischer Fachliteratur und wissenschaftlicher Quellen geprüft.
Sie sind hier: Startseite Anatomie Titin
Das elastische Protein Titin besteht aus etwa 30.000 Aminosäuren und stellt damit das größte bekannte menschliche Protein dar.
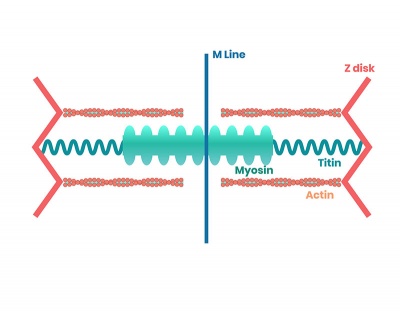
Als Bestandteil der Sarkomere, der kleinsten kontraktilen Einheit der Skelett- und Herzmuskulatur, sorgt Titin in Form von Filamenten für die elastische Verbindung zwischen den Z-Scheiben und den Myosinköpfen. Titinfilamente sind passiv vorgespannt und ziehen die Myosinfilamente nach einer Kontraktion wieder zurück, was in etwa mit der Funktion einer vorgespannten Rückholfeder einer Maschine vergleichbar ist.
Inhaltsverzeichnis |
Was ist Titin?
Titin ist ein vergleichsweise riesiges, elastisches Protein mit einer Molekülmasse von etwa 3,6 Millionen Dalton und verkörpert damit das größte bekannte menschliche Proteinmolekül. Das auch als Connectin bezeichnete Titin ist ein wichtiger Bestandteil der quergestreiften Skelett- und Herzmuskulatur.
Aneinandergereiht schließen sich Titinmoleküle zu elastischen Titinfilamenten zusammen und halten im Sarkomer, der kleinsten kontraktilen Einheit der Muskeln, die Myosinfilamente in Position. Nach erfolgter Kontraktion und anschließender Entspannung des Muskels unterstützen sie durch ihre elastische Vorspannung die Repositionierung der Myosinfilamente. Während der Ruhephase des Muskels sorgen die Titinfilamente für eine anhaltende leichte Muskelspannung.
Nach international gültigen Regeln der „International Union of Pure and Applied Chemistry“ (IUPAC) werden Proteine nach ihren enthaltenen Aminosäuren benannt und zwar gemäß ihrer primären Sequenz. Wenn diese Regel auf Titin angewandt wird, entsteht ein Akronym mit fast 190.000 Buchstaben, dessen Verlesung mehrere Stunden dauern würde.
Anatomie & Aufbau
Jedes einzelne Myosinfilament ist an seinen Enden jeweils mit einem Titinfilament verbunden, das jeweils an der Z-Scheibe verankert ist, so dass die Myosinfilamente während der Ruhe- und auch während der Kontraktionsphase von den Titinfilamenten in der richtigen Position gehalten werden. Die etwa 30.000 Aminosäuren sind in insgesamt 320 Proteindomänen geordnet. Proteindomänen bestehen aus einer Abfolge von Aminosäuren, die unabhängig vom restlichen Proteinmolekül als eigenständiges Protein oder Polypeptid agieren und physiologische Funktionen übernehmen könnten.
Mehrere Hundert hintereinandergeschaltete Sarkomere bilden eine Muskel- oder Myofibrille, die sich wiederum zu mehreren Hundert zu einer Muskelfaser zusammenschließen. Unter dem Lichtmikroskop sind die einzelnen Zonen der parallel und hintereinander angelegten Sarkomere als Querstreifung sichtbar. Jeweils rechts und links der dunkel erscheinenden Z-Scheiben lassen sich die helleren sogenannten I-Bänder erkennen, die neben Aktinfilamenten hauptsächlich das elastische Titin enthalten.
Funktion & Aufgaben
Die kontraktile Funktion eines Sarkomers, der kleinsten Funktionseinheit innerhalb einer quergestreiften Muskelzelle beruht auf Myosinfilamenten, die sich während der Muskelkontraktion ineinanderschieben und so die Verkürzung des Sarkomers bewirken. Damit sich die Verkürzung der Myosinfilamente auf den gesamten Muskel auswirkt, sind sie auf beiden Seiten mit Titinfilamenten verbunden, die wiederum mit den Z-Scheiben verankert sind.
Das bedeutet, dass die Titinfilamente eine elastische Verbindung zwischen den Myosinfilamenten und den Z-Scheiben bilden. Die Titinfilamente sorgen durch eine Art Vorspannung dafür, dass die Myosinfilamente sowohl im entspannten wie auch im kontrahierten Zustand in zentraler Position zwischen den sie umgebenden Aktinfilamenten gehalten werden. Die Elastizität des Titins bewirkt, dass die Kontraktions- und Entspannungsphasen des Muskels nicht ruckartig aufeinander folgen, sondern gebremst ablaufen und feinmotorisch besser gesteuert werden können. Darüber hinaus wirken die Titinfilamente einer Verletzung der Muskelfasern bei starker und gewaltsamer Dehnung durch elastisches „Nachgeben“ entgegen.
Zusätzlich erhöhen die Titinfilamente die Gesamtstrecke, um die sich ein Muskel insgesamt verkürzen kann, weil sich die Titinfilamente während der Kontraktionsphase ebenfalls verkürzen und die kontraktile Wegstrecke des Sarkomers erhöhen. Während der Entspannungsphase des Muskels ist die Wirkung der Titinfilamente wegen ihrer Grundspannung mit dem Arbeitsprinzip einer Rückholfeder vergleichbar. Die Elastizität des Titins unterstützt damit passiv die Arbeit des antagonistischen Muskels, der prinzipiell dafür sorgt, dass die Sarkomere wieder auf ihre ursprüngliche Länge „gezogen“ werden.
Krankheiten
Nach neueren Erkenntnissen wird der Muskelkater von Mikrorissen an den Z-Scheiben der Sarkomere und der Zerstörung der Haltestrukturen für Titin und anderen beteiligten Proteinen verursacht. Sehr wahrscheinlich kommen die typischen Muskelkaterschmerzen durch eine Reaktion der Muskelzellen auf die Miniverletzungen zustande. Es entstehen schmerzhafte Entzündungsreaktionen, die eine zügige Reparatur der Sarkomere ermöglichen sollen. Im Zusammenhang mit Muskelkater ist noch immer die Meinung anzutreffen, dass es sich um eine Übersäuerung des Muskels mit Milchsäure handele, eine Annahme, die mittlerweile widerlegt wurde.
Myasthenia gravis ist eine selten auftretende neuromuskuläre Krankheit, an der auch Titin beteiligt ist. Es handelt sich um eine Störung der motorischen Signalübertragung an die Muskelzellen. Autoantikörper blockieren die Acetylcholinrezeptoren der motorischen Endplatte. Autoantikörper richten sich gegen körpereigene Gewebe oder Hormone. Bei den meisten Patienten, die unter der Myasthenia gravis leiden, lassen sich Antikörper gegen das Proteinfragment MGT30 nachweisen.
Es handelt sich um ein Polypeptid mit einer Molekülmasse von 30.000 Dalton, das im Titin enthalten ist. Der Nachweis der Antikörper gegen eine Teilstruktur des Titin dient der Differentialdiagnose bei Verdacht auf Vorliegen der Autoimmunkrankheit Myasthenia gravis.
Quellen
- Benninghoff/Drenckhahn: Anatomie. Urban & Fischer, München 2008
- Plattner, H., Hentschel, J.: Zellbiologie. Thieme, Stuttgart 2017
- Reuter, P., Hägele, J.: Aminosäuren Kompendium. Ein Leitfaden für die klinische Praxis. Hyginus Publisher GmbH, Bad Homburg 2001