Polyomaviridae
 Medizinische Expertise: Dr. med. Nonnenmacher
Medizinische Expertise: Dr. med. NonnenmacherQualitätssicherung: Dipl.-Biol. Elke Löbel, Dr. rer. nat. Frank Meyer
Letzte Aktualisierung am: 5. September 2024Dieser Artikel wurde unter Maßgabe medizinischer Fachliteratur und wissenschaftlicher Quellen geprüft.
Sie sind hier: Startseite Krankheitserreger Polyomaviridae
Polyomaviridae sind eine Gruppe von DNA-Viren ohne Virushülle, die ein Erbmaterial aus DNA besitzen und ein Kapsid aus mehr als 70 Kapsomeren enthalten. Zu der Gattung zählen zum Beispiel Viren wie das Humane Polyomavirus oder das BK- und JC-Virus. Speziell da BK-Virus hat sich mittlerweile stark an den Menschen als Wirt angepasst.
Inhaltsverzeichnis |
Was sind Polyomaviridae?
© Polyomaviridae– stock.adobe.com
Die Polyomaviridae entsprechen DNA-Viren ohne Virushülle. Ihr Erbmaterial besteht aus DNA. Die Polyomaviridae spielen vorwiegend für die Wirbeltiere eine Rolle. Die befallenen Organismen leiden an persistierenden Infektionen verschiedener Art.
Das Murine Polyomavirus wurde als erstes Polyomavirus dokumentiert. Dieses Virus ruft an neugeborenen Mäusen verschiedene Arten von Tumoren hervor. Zu den Polyomaviridae zählt vor allem diese Gattung der Polyomaviren, die wiederum verschiedene Unterspezies umfasst. Zu diesen Spezies zählen neben dem Meerkatzen-Polyomavirus zum Beispiel das Pavian-Polyomavirus 2, das Humane Polyomavirus oder das Bovine Polyomavirus. Vorläufig wurden außerdem Spezies wie das Schimpansen-Polyomavirus und das Merkelzell-Polyomavirus als Arten innerhalb der Gattung Polyomavirus klassifiziert.
Biologische Eigenschaften
Polyomaviridae sind eine Familie von kleinen, unbehüllten DNA-Viren, die sowohl Säugetiere als auch Vögel infizieren können. Sie gehören zur Klasse der Papovaviricetes und zur Ordnung Zurhausenvirales. Innerhalb der Familie gibt es mehrere Gattungen, wobei die humanpathogenen Vertreter wie das JC-Virus und BK-Virus zu den bedeutendsten zählen. Sie sind in der Lage, verschiedene Zelltypen zu infizieren und können unter bestimmten Bedingungen Tumore auslösen.
Morphologisch sind Polyomaviren etwa 40-45 nm groß und besitzen eine ikosaedrische Kapsidstruktur, die aus den Strukturproteinen VP1, VP2 und VP3 besteht. Da sie keine Hülle haben, sind sie widerstandsfähig gegenüber Umwelteinflüssen und können lange Zeit außerhalb eines Wirts überleben.
Das Genom von Polyomaviren besteht aus einer zirkulären, doppelsträngigen DNA von etwa 5.000 Basenpaaren. Charakteristisch für diese Viren ist die Organisation des Genoms in zwei Hauptbereiche: den frühen und den späten Bereich. Der frühe Bereich kodiert für die regulatorischen Proteine, darunter das T-Antigen, das essenziell für die virale Replikation und Transformation der Wirtszellen ist. Der späte Bereich kodiert für die Strukturproteine des Virions. Eine Besonderheit ist, dass Polyomaviren keine eigenen Enzyme zur DNA-Replikation besitzen und daher vollständig auf die maschinelle Ausstattung der Wirtszelle angewiesen sind, um sich zu vermehren.
Vorkommen, Verbreitung & Eigenschaften
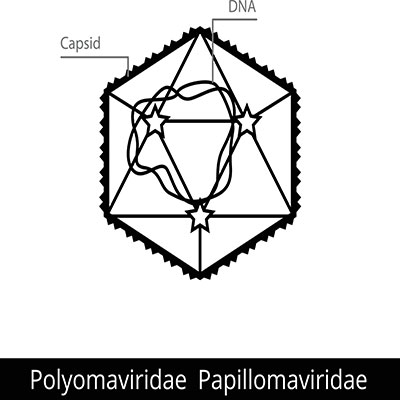
Die Virus-Ionen eines Polyomavirus setzen sich aus einem nackten Kapsid mit einem Durchmesser zwischen 40 und 45 nm zusammen. Jedes Kapsid besteht aus 72 Kapsomeren. Diese Kapsomere sind in ihrer Anordnung ikosaedrisch symmetrisch und werden an ihrer Basis von fünf verschiedenen Molekülen geformt. Die Moleküle dieses Pentamers liegen nicht gleichförmig zueinander, sondern windschief. Die Rede ist deshalb von verdreht ikosaedrischer Symmetrie. Das Innere des Kapids wird von Kapsidproteinen VP2 und VP3 stabilisiert, die das VP1-Gerüst des Kapids bilden. Die einzelnen Proteine stehen in Interaktion mit der DNA im Kapsid.
Teilweise weisen Viruspartikel im Einzelfall von diesem Aufbau ab und können so zum Beispiel auch normal strukturierten Kapsiden entsprechen, als Mikrokapside in Erscheinung treten oder unregelmäßig röhrenartige Struktur aufweisen.
VP1-Kapsidproteine können sich zusammenlagern und auf diese Weise ohne Zuhilfenahme weiterer Virusproteine einen virusähnlichen Partikel bilden. Die so gebildeten Partikel sind allerdings nicht zur Verpackung von Nukleinsäure in der Lage.
Innerhalb der Kapside liegt je ein kovalent geschlossener Ring aus DNA des Virusgenoms. Wie auch bei der Gattung der Papillomaviridae ist der Ring mehrfach verdrillt. Gemeinsam mit den zellulären Histonen bildet der DNA-Ring Nukleoproteinkomplexe mit struktureller Ähnlichkeit zu eukaryotischen Nukleosomen.
Umweltstabilität ist eine der wichtigsten Eigenschaften der Kapside. Aufgrund dieser Eigenschaft lassen sich Polyomaviridae mittels Diethylether oder Detergenzien nicht inaktivieren. Damit ist das Händewaschen mit Seife beispielsweise keine wirksame Vorbeugemaßnahme gegenüber diesen Viren. Auch Temperaturen können ihnen kaum etwas anhaben: bis 50 Grad Celsius gelten sie für eine Stunde als hitzestabil. Nur Hitze in Kombination mit Magnesiumchlorid macht die Kapside instabil, da ihre Kapsid-Struktur vermutlich von zweiwertigen Kationen abhängig ist.
Krankheiten & Beschwerden
Aviäre Polyomaviren rufen verschiedene Infektionen hervor, so zum Beispiel die französische Mauser. Bei Menschen mit Immunsuppression kann das BK-Virus nach einer Nierentransplantation den Transplantatverlust begünstigen. Das BK-Virus ist außerdem mit Atemwegsinfektionen und bei Kindern mit Zystitis assoziiert. Bei Patienten nach Knochenmarks-Transplantationen tritt oft eine hämorrhagische Zystitis auf. Bei Patienten mit Nierentransplantaten kann das Virus Ureterstenose hervorrufen. Darüber hinaus erkranken AIDS-Patienten durch das Virus unter Umständen an einer Meningoenzephalitis. Die BK- und JC-Viren halten sich im Gewebe der Nieren.
Infektionen mit den Viren nehmen äußerst selten einen tödlichen Verlauf, da sich die Viren an den Menschen als Wirt angepasst haben und ihren Reservoirwirt aufgrund eigener Nachteile nicht in dieser Weise schädigen wollen. Auch der Mensch hat sich im Verlauf der Generationen an den Virus angepasst. Die aktuelle Durchseuchung der Bevölkerung mit dem BK-Virus wird auf bis zu 90 Prozent geschätzt.
Das JC-Virus kann jedoch für immunsupprimierten Patienten schwerwiegende Folgen, wie eine progressiv multifokale Leukoenzephalopathie, haben. PML ist darüber hinaus mit einem oft tödlichen Verlauf assoziiert. Mit dem simianen Virus 40 sind verschiedene Tumorerkrankungen assoziiert. Die Durchseuchung der Bevölkerung mit diesen Spezies der Polyomaviridae ist weitaus geringer als für die BK-Viren. Die Anpassung von Virus an Mensch und Mensch an Virus ist für diese Spezies weniger fortgeschritten.
Behandlungsmöglichkeiten
Die Behandlung von Infektionen mit Polyomaviridae, insbesondere durch das JC-Virus und BK-Virus, stellt eine besondere Herausforderung dar, da es keine spezifischen antiviralen Medikamente gibt, die gezielt gegen diese Viren wirken. Bei immungesunden Personen verlaufen Infektionen häufig asymptomatisch oder mild. Bei immungeschwächten Patienten, wie Organtransplantierten oder Menschen mit HIV, können Polyomaviren jedoch schwerwiegende Erkrankungen wie progressive multifokale Leukoenzephalopathie (PML) oder nephropathische Komplikationen verursachen.
Standardtherapien zielen meist darauf ab, das Immunsystem zu stärken. Bei Organtransplantierten kann die Dosis immunsuppressiver Medikamente reduziert werden, um dem Immunsystem zu ermöglichen, die Viruslast zu kontrollieren. Bei HIV-Patienten wird eine optimierte antiretrovirale Therapie eingesetzt, um die Immunfunktion zu verbessern. Unterstützend können antivirale Mittel wie Cidofovir, die gegen DNA-Viren wirken, angewendet werden, obwohl ihre Wirksamkeit begrenzt ist.
Resistente Stämme oder anhaltende Infektionen stellen eine Herausforderung dar, da es bisher keine klar wirksamen Therapien gibt. Experimentelle Ansätze umfassen die Nutzung von Immuntherapien, etwa durch den Einsatz von monoklonalen Antikörpern, die gezielt gegen virale Proteine gerichtet sind. Ein vielversprechender experimenteller Ansatz sind auch antikörperbasierte Therapien oder die Hemmung des T-Antigens, um die Virusreplikation zu verhindern. Weiterhin werden Medikamente erforscht, die die virale Replikation hemmen, indem sie die Interaktion der Viren mit den zellulären Replikationsmechanismen blockieren.
JC-Virus und progressive multifokale Leukoenzephalopathie
Das JC-Virus (JCV), ein Mitglied der Polyomaviridae-Familie, ist ein häufiger Erreger, der bei einem Großteil der erwachsenen Bevölkerung latent im Körper vorhanden ist, ohne Symptome zu verursachen. Unter normalen Umständen wird das Virus vom Immunsystem in Schach gehalten. Bei immungeschwächten Personen jedoch, insbesondere bei Menschen mit HIV, Patienten unter immunsuppressiver Therapie oder solchen mit Autoimmunerkrankungen wie Multipler Sklerose, kann das JC-Virus reaktiviert werden und die gefährliche, oft tödliche Erkrankung progressive multifokale Leukoenzephalopathie (PML) hervorrufen.
PML ist eine seltene, aber schwerwiegende neurologische Erkrankung, die durch das JC-Virus verursacht wird und die weiße Substanz des Gehirns angreift. Das Virus infiziert und zerstört die Oligodendrozyten, die für die Bildung der Myelinscheiden um die Nervenzellen verantwortlich sind. Dies führt zu einer fortschreitenden Schädigung des Nervensystems, die sich durch verschiedene Symptome äußert, darunter motorische Schwächen, Sehstörungen, Sprachprobleme und kognitive Beeinträchtigungen. Die Krankheit schreitet schnell voran und ist ohne Behandlung meist innerhalb weniger Monate tödlich.
Die größte Herausforderung bei der Behandlung von PML besteht darin, dass es keine spezifische antivirale Therapie gegen das JC-Virus gibt. Die wichtigste therapeutische Strategie ist die Wiederherstellung der Immunfunktion, um das Virus wieder unter Kontrolle zu bringen. Bei HIV-Patienten hat die Einführung der antiretroviralen Therapie (ART) zu einem Rückgang der PML-Fälle geführt, da ART das Immunsystem stärkt und somit die JC-Virus-Replikation unterdrückt. Bei Patienten, die immunsuppressive Medikamente, etwa aufgrund einer Organtransplantation oder bei der Behandlung von Autoimmunerkrankungen, einnehmen, wird oft versucht, die Dosis der Immunsuppressiva zu reduzieren.
In den letzten Jahren haben Forscher nach alternativen Therapieansätzen gesucht, um die Behandlung von PML zu verbessern. Eine experimentelle Strategie ist die Verwendung von monoklonalen Antikörpern wie Pembrolizumab, die das Immunsystem stimulieren, indem sie Immun-Checkpoints blockieren und somit die Immunantwort gegen das Virus verstärken. Auch die adoptive T-Zell-Therapie wird erforscht, bei der Patienten mit T-Zellen behandelt werden, die speziell auf das JC-Virus abzielen.
Trotz dieser vielversprechenden Ansätze bleibt PML eine sehr ernste Erkrankung mit hoher Mortalität. Die Früherkennung ist entscheidend, da eine frühzeitige Diagnose und Intervention die Chancen auf eine Stabilisierung der Erkrankung erhöhen. Langfristig bleibt die Erforschung von Therapien gegen das JC-Virus ein wichtiges Ziel, um die Behandlung von PML und anderen JC-Virus-assoziierten Erkrankungen zu verbessern.
BK-Virus: Risiken bei Nierentransplantationen
Das BK-Virus, ein weiteres Mitglied der Polyomaviridae-Familie, ist für die meisten Menschen harmlos und bleibt nach einer primären Infektion, meist im Kindesalter, latent im Körper vorhanden. Bei gesunden Menschen verursacht das BK-Virus in der Regel keine Symptome. Jedoch kann es bei immungeschwächten Personen, insbesondere nach Nierentransplantationen, zu einer Reaktivierung des Virus kommen, was schwerwiegende gesundheitliche Folgen haben kann.
Nach einer Nierentransplantation wird das Immunsystem des Patienten mit immunsuppressiven Medikamenten unterdrückt, um die Abstoßung des Transplantats zu verhindern. Diese Immunsuppression kann jedoch die Kontrolle über das latent vorhandene BK-Virus beeinträchtigen, was zur Reaktivierung des Virus führt. Eine der schwerwiegendsten Komplikationen in diesem Zusammenhang ist die BK-Virus-assoziierte Nephropathie (BKVAN), eine Entzündung der transplantierten Niere, die durch die direkte Infektion des BK-Virus verursacht wird. Dies kann zu einer Verschlechterung der Nierenfunktion und, im schlimmsten Fall, zum Verlust des Transplantats führen.
Die Symptome einer BK-Virus-Infektion bei Nierentransplantierten sind oft subtil und unspezifisch, was die Diagnose erschwert. Häufige Anzeichen sind ein Anstieg des Kreatininspiegels im Blut, der auf eine Verschlechterung der Nierenfunktion hinweist, sowie Fieber und allgemeines Unwohlsein. Oft wird die Diagnose erst durch den Nachweis von BK-Virus-DNA im Urin oder Blut des Patienten gestellt, was mittels Polymerase-Kettenreaktion (PCR) erfolgt.
Die Behandlung einer BK-Virus-assoziierten Nephropathie stellt eine Herausforderung dar, da es derzeit keine spezifische antivirale Therapie gegen das BK-Virus gibt. Die Hauptstrategie besteht darin, die immunsuppressive Therapie zu reduzieren, um dem Immunsystem die Möglichkeit zu geben, das Virus wieder unter Kontrolle zu bringen. Dies erfordert jedoch eine sorgfältige Abwägung, da eine zu starke Reduzierung der Immunsuppression die Gefahr der Abstoßung des Transplantats birgt. In einigen Fällen können immunmodulierende Therapien wie intravenöse Immunglobuline (IVIG) eingesetzt werden, um die Immunantwort zu unterstützen.
Neben der Reduktion der Immunsuppression werden experimentelle Ansätze zur Bekämpfung des BK-Virus untersucht. Eine mögliche Therapie besteht in der Anwendung von Leflunomid, einem Immunsuppressivum, das gleichzeitig antivirale Eigenschaften aufweist. Auch antivirale Medikamente wie Cidofovir werden gelegentlich eingesetzt, obwohl deren Wirksamkeit gegen das BK-Virus umstritten ist und mit erheblichen Nebenwirkungen einhergehen kann.
Das Monitoring von Nierentransplantierten auf eine mögliche BK-Virus-Reaktivierung ist entscheidend, um Komplikationen frühzeitig zu erkennen und zu behandeln. Regelmäßige Kontrollen des Kreatininspiegels sowie die Überwachung der BK-Viruslast im Urin und Blut sind wichtige Bestandteile des Nachsorgeprotokolls.
Quellen
- Doerfler, W.: Viren. Fischer Taschenbuch, Berlin 2015
- Hofmann, F., Tiller, F.,W.: Praktische Infektiologie. ecomed-Storck, Hamburg 2011
- Neumeister, B., Geiss, H., Braun, R.: Mikrobiologische Diagnostik. Thieme, Stuttgart 2009
