Elastasen
 Medizinische Expertise: Dr. med. Nonnenmacher
Medizinische Expertise: Dr. med. NonnenmacherQualitätssicherung: Dipl.-Biol. Elke Löbel, Dr. rer. nat. Frank Meyer
Letzte Aktualisierung am: 24. März 2024Dieser Artikel wurde unter Maßgabe medizinischer Fachliteratur und wissenschaftlicher Quellen geprüft.
Sie sind hier: Startseite Laborwerte Elastasen
Elastasen stellen eine Gruppe von Proteasen dar, die mit den Enzymen Trypsin und Chymotrypsin eng verwandt sind. Sie gehören zu den Serinproteasen. Für den menschlichen Organismus sind bisher neun zu den Elastasen gehörende Enzyme bekannt.
Inhaltsverzeichnis |
Was sind Elastasen?
Elastasen sind unspezifisch wirkende Proteasen, die in allen tierischen und menschlichen Organismen vorkommen. Der Name rührt daher, weil sie unter anderem in der Lage sind, körpereigenes Elastin abzubauen. Die Elastasen gehören zu den Serinproteasen.
Ihr aktives Zentrum enthält die sogenannte katalytische Triade aus Asparaginsäure, Serin und Histidin. Des Weiteren gehören die Elastasen auch zu den Endoproteasen. Sie bauen die Proteine und Polypeptidketten nicht Schritt für Schritt ab, sondern spalten diese an bestimmten Aminosäuren und charakteristischen Aminosäuresequenzen. Das Protein wird innerhalb der Peptidkette aufgebrochen. Die Wirkung der Elastasen ist nicht spezifisch. So können auch körpereigene Proteine aus dem Elastin abgebaut werden. Daher muss die Wirkung dieser Enzyme durch Elastaseinhibitoren begrenzt werden. Unter den Elastasen werden zwei Formen unterschieden.
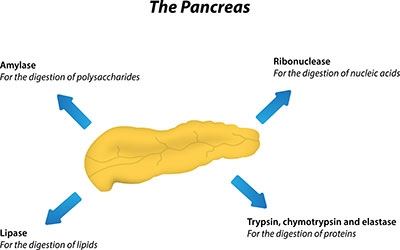
So gibt es Pankreaselastasen und Granulozyten-Elastasen. Wie der Name bereits sagt, werden Pankreaselastasen (Elastase 1) aus dem Pankreas sezerniert. Die Granulozyten-Elastase (Elastase 2) befindet sich in den neutrophilen Granulozyten. Ein Mangel an Elastase 1 im Stuhl gilt als Nachweis für eine Pankreasinsuffizienz.
Funktion, Wirkung & Aufgaben
Sie wird in der Bauchspeicheldrüse als inaktives Proenzym (Zymogen) gebildet und nach Freisetzung in den Dünndarm durch die Wirkung von Trypsin in die aktive Form überführt. Dabei wird aus dem Zymogen eine Teilkette abgespalten. Elastase 1 spaltet insbesondere das Faserprotein Elastin. Elastin ist Bestandteil des Bindegewebes von Lunge, Blutgefäßen und Haut. Es hat im Organismus hauptsächlich eine Stützfunktion zu erfüllen. Elastin gibt den Organen Form und Halt. Da es Proteinnetzwerke über Zusammenschlüsse von vier Lysinmolekülen bildet, kann es von vielen Proteasen nicht abgebaut werden. Allerdings besitzt Elastase 1 dazu die Fähigkeit. Elastinbestandteile aus der Nahrung werden aufgespalten und können so aufbereitet weiter zu Aminosäuren abgebaut werden.
Leider ist die Wirkung von Elastase unspezifisch, sodass sie auch körpereigene Elastinstrukturen angreifen kann. Dafür bildet der Körper Elastinhemmproteine, welche die zerstörerische Wirkung von Elastin kontrollieren können. Zu diesen Proteinen zählt α1-Antitrypsin, Alpha-2-Makroglobulin oder Elafin. Die zweite Gruppe von Elastasen repräsentieren als ELA-2 die Granulozyten-Elastase. Sie haben die Aufgabe, phagozytierte Mikroorganismen im Rahmen einer Immunreaktion bei Infektionen abzubauen. Allerdings wirken auch sie unspezifisch und greifen körpereigenes Elastin an. Wenn dabei die Wirkung der Elastasehemmproteine eingeschränkt ist, kann es unter anderem zur Zerstörung von Lungengewebe unter Bildung eines Lungenemphysems kommen.
Bildung, Vorkommen, Eigenschaften & optimale Werte
Im menschlichen Organismus sind Elastasen unabhängig von ihrem Syntheseort wichtige Unterstützer des Immunsystems bei der Bekämpfung von gramnegativen Keimen im Verdauungstrakt, in der Lunge und auf Wunden. Dabei spalten sie die entsprechenden Proteine an der Carboxyseite von hydrophoben Aminosäuren, wozu unter anderem Valin, Glycin und Alanin gehören. Allerdings ist ihre Wirkung, wie bereits erwähnt, immer unspezifisch.
Der menschliche Körper setzt täglich ca. 500 Milligramm Elastase um. Elastase wird im Körper nicht abgebaut. Es wird unverändert im Stuhl ausgeschieden. Über die ausgeschiedene Menge im Stuhl kann die Funktion der Bauchspeicheldrüse geprüft werden. Zwar wird auch Chymotrypsin mit den Faeces ausgeschieden. Allerdings kann die Bestimmung von Elastase eindeutiger zu Diagnosezwecken genutzt werden. Die normale Elastasekonzentration beträgt mindestens 200 Mikrogramm pro Gramm Stuhl.
Krankheiten & Störungen
Bei Werten unter 100 Mikrogramm liegt eine schwere Pankreasinsuffizienz vor. Der Elastasenachweis im Stuhl ist ein charakteristisches Diagnosemerkmal einer Bauchspeicheldrüsenunterfunktion. Dabei handelt es sich um die exokrine Funktion des Pankreas. Die Insulinbildung kann davon unberührt sein. Bei einer Pankreasinsuffizienz werden zu wenig Verdauungsenzyme sezerniert. Das gilt sowohl für Proteasen als auch für Lipasen und Amylasen. Viele Nahrungsbestandteile gelangen unverdaut in den Dickdarm, wo sie weiter durch pathogene Bakterien aufgeschlossen werden. Die pathogenen Keime können nur gedeihen, wenn noch genügend unverdaute Nahrungsbestandteile vorhanden sind. Es entwickeln sich Fäulnis- und Gärungsprozesse, welche zu Meteorismus, Diarrhoe und Bauchbeschwerden führen.
Da auch Fette nicht mehr aufgeschlossen werden, kann es zu Fettstuhl kommen. Die Ursache der Unterfunktion des Pankreas kann durch eine akute oder chronische Pankreatitis bedingt sein. Eine Pankreatitis ist in der Regel die Folge der Selbstverdauung eines Teils der Bauchspeicheldrüse durch nicht abfließende Verdauungssäfte. Der Pankreasausgang kann aufgrund von Tumoren oder Gallensteinen verengt sein. Auch Abflussstörungen durch Missbildungen sind möglich. Eine langwierige chronische Pankreatitis führt langfristig zur Funktionseinschränkung der Bauchspeicheldrüse mit verminderter Enzymproduktion. Besteht ein Elastasemangel von Elastase 2 aufgrund eines genetischen Defektes, ist das Immunsystem des betroffenen Patienten geschwächt. Dabei kommt es ständig zu lebensgefährlichen Infektionen.
Bei einem Mangel an Elastaseinhibitoren wie Alpha-1-Antitrypsin oder verstärkter Aktivität der Elastase bei Lungenentzündungen kann die Lungenfunktion stark eingeschränkt werden. Langfristig entwickelt sich daraus ein Lungenemphysem. Bei genetisch bedingtem Alpha-1-Antitrypsin-Mangel erfolgt eine lebenslange Substitutionstherapie mit gentechnisch hergestelltem Alpha-1-Antitrypsin.
Quellen
- Bisswanger, H.: Enzyme. Struktur, Kinetik und Anwendungen. Wiley-VHC, Weinheim 2015
- Deschka, M.: Laborwerte A-Z. Kohlhammer, Stuttgart 2011
- Hahn, J.-M.: Checkliste Innere Medizin. Thieme, Stuttgart 2013