Elastin
 Medizinische Expertise: Dr. med. Nonnenmacher
Medizinische Expertise: Dr. med. NonnenmacherQualitätssicherung: Dipl.-Biol. Elke Löbel, Dr. rer. nat. Frank Meyer
Letzte Aktualisierung am: 6. März 2024Dieser Artikel wurde unter Maßgabe medizinischer Fachliteratur und wissenschaftlicher Quellen geprüft.
Sie sind hier: Startseite Laborwerte Elastin
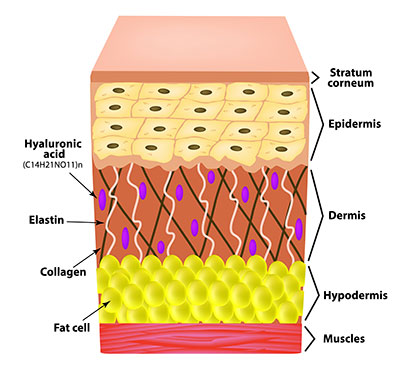
Elastin ist ein Strukturprotein, welches beim Aufbau des Bindegewebes von Lunge, Blutgefäßen und Haut beteiligt ist. Es ist im Gegensatz zum ebenfalls im Bindegewebe vorkommenden Kollagen sehr elastisch. Die Elastinmoleküle vernetzen sich untereinander im extrazellulären Bereich.
Inhaltsverzeichnis |
Was ist Elastin?
Alle Wirbeltiere enthalten das Faserprotein Elastin. Es ist ein Strukturprotein, welches für die Formgebung solcher wichtiger Organe wie Lunge, Blutgefäße oder Haut verantwortlich ist. Zusammen mir Kollagen bildet es das Bindegewebe dieser Organe.
Die Eigenschaften von Elastin und Kollagen ergänzen sich. So ist Elastin, wie der Name schon sagt, im Gegensatz zu Kollagen sehr elastisch. Dadurch wird das Bindegewebe von Haut, Lunge und Blutgefäßen dehnbar und verformbar. Die Funktionen dieser drei Organe erfordern eine ständige Größenanpassung. Elastin ist hauptsächlich aus den Aminosäuren Alanin, Glycin, Prolin, Valin, Lysin, Leucin und Isoleucin aufgebaut. Innerhalb des Moleküls wechseln sich hydrophobe und hydrophile Bereiche ab.
In jeder hydrophoben Domäne wiederholen sich charakteristische Einheiten der vier Aminosäuren Alanin, Prolin, Glycin und Valin. Die hydrophilen Bereiche besitzen hauptsächlich Lysin. Der Lysinrest wird zu Allysin oxidiert durch das Enzym Lysyloxidase. Dabei kommt es zum Austausch der endständigen Aminogruppe durch eine Carboxylgruppe. Die Lysinreste der verschiedenen Proteinketten verbinden sich miteinander zu einem ringförmigen Desmosin und vernetzen dadurch die unterschiedlichen Ketten miteinander.
Funktion, Wirkung & Aufgaben
Das Bindegewebe besitzt als Strukturprotein zum größten Teil Kollagen. Es ist reißfest, wäre aber als alleiniges Strukturelement zu starr. Erst die Verknüpfung der Eigenschaften von Elastin und Kollagen lässt das Bindegewebe dehnbar und gleichzeitig reißfest werden. Der Grundbaustein des Elastins ist das Tropoelastin. Tropoelastin setzt sich aus alternierenden hydrophoben und hydrophilen Domänen zusammen. Es besitzt eine ungefähre Molekülmasse von 72 Kilodalton. Die Tropoelastineinheiten vernetzen sich untereinander an den Lysinresten.
Während Tropoelastin aufgrund der vielen hydrophilen Domänen wasserlöslich ist, wird die Wasserlöslichkeit des vernetzten Polymers aufgehoben. Tropoelastin wird innerhalb der Zellen gebildet und gelangt über den Membrantransport in den extrazellulären Bereich. Dort erfolgt dann die Vernetzung der Grundbausteine, wobei sich an den Vernetzungsstellen ringförmige Desmosineinheiten bilden. An der Desmosinbildung nehmen immer drei Allysinreste und ein Lysinrest teil. Da Allysin ein Oxidationsprodukt von Lysin darstellt, sind letztlich vier Lysinreste miteinander verknüpft.
Diese Form der Verbindung verleiht dem Elastin seine besondere Elastizität. Die Vernetzung schützt Elastin auch vor der Denaturierung und dem Abbau durch fast alle Proteasen. Allerdings stellt das Enzym Elastase eine Ausnahme dar. Es ist als einzige Protease in der Lage, Elastin abzubauen. So gelingt auch der Abbau der durch die Nahrung aufgenommenen Elastine.
Bildung, Vorkommen, Eigenschaften & optimale Werte
Wie bereits erwähnt, ist Elastin notwendiger Bestandteil des Bindegewebes von Lunge, Blutgefäßen und Haut. Das betrifft alle Wirbeltiere. Der Grundbaustein Tropoelastin kann im tierischen Gewebe kaum nachgewiesen werden. Nach der Umwandlung von Lysinresten zu Allysin durch die Lysyloxidase kommt es sofort zur Vernetzung von drei Allysinresten mit einem Lysinrest. Elastin kommt fast nur in seiner vernetzten Form vor.
Trotzdem ist der Nachweis von Tropoelastin im Tierversuch durch die Hemmung der Synthese von Lysyloxidase gelungen. Fehlt dieses Enzym, kommt es nicht zur Umwandlung von Lysin zu Allysin und damit auch nicht zur Elastinbildung. Durch die Widerstandsfähigkeit von Elastin gegen den Abbau durch Proteasen sind Haut, Lunge und Blutgefäße ideal geschützt. Die abbauende Wirkung von Elastase wird durch Elastaseinhibitoren eingeschränkt.
Krankheiten & Störungen
Die Krankheit kann sowohl erworben als auch erblich bedingt sein. Familiäre Häufungen werden beobachtet. Neben vielen anderen Symptomen tritt diese Bindegewebsschwäche auch beim Williams-Beuren-Syndrom auf. Auch hier handelt es sich um eine erblich bedingte Strukturanomalie von Elastin. Die Ursache für diese Erkrankung stellt eine Mutation auf Chromosom 7 dar. Des Weiteren gibt es auch eine angeborene Aortenstenose, die auf einer Störung des Elastinaufbaus beruht. Dabei ist die Hauptschlagader des Herzens verengt. Aus der linken Herzkammer kann das Blut nur verzögert in den Blutkreislauf fließen.
Langfristig kommt es zu einer Herzinsuffizienz. Fünf bis sechs Prozent aller angeborenen Herzfehler sind angeborene Aortenstenosen. Auch bei einigen Formen des Ehlers-Danlos-Syndroms wird von einer Elastinfehlbildung ausgegangen. Diese Erkrankung ist durch eine überdehnbare Haut gekennzeichnet, wobei von Gummihaut gesprochen wird. Die Schwäche des Bindegewebes beeinträchtigt viele Organe, darunter auch das Herz und den Verdauungstrakt. Das Syndrom wird meist autosomal dominant vererbt.
Beim sogenannten Menkes-Syndrom wiederum kommt es neben vielen anderen Symptomen auch zu einer Bindegewebsschwäche, deren Ursache in einer gestörten Elastinsynthese zu suchen ist. Eigentlich ist das Menkes-Syndrom durch eine Störung der Kupferaufnahme im Körper gekennzeichnet. Kupfer ist allerdings ein Cofaktor für viele Enzyme. Unter anderem gehört dazu auch die Lysyloxidase. Ohne Kupfer ist das Enzym unwirksam. Die Umwandlung der Lysinreste in Allysin findet nicht mehr statt. In der Folge kann auch die Vernetzung der Lysinreste zu Desmosin nicht mehr funktionieren.
Quellen
- Dormann, A., Luley, C., Heer, C.: Laborwerte. Urban & Fischer, München 2005
- Horn, F.: Biochemie des Menschen. Das Lehrbuch für das Medizinstudium. Thieme, Stuttgart 2018
- Piper, W.: Innere Medizin. Springer, Berlin 2013